Créés en 2011, les laboratoires des médicaments d’importation parallèle (LEMI) sont devenus “Affordable Medicines France” en 2022. L’association a pour objet d’assurer un accès des médicaments à un prix abordable à l’ensemble des patients français. Elle représente les laboratoires exploitant des autorisations d’importation parallèle (AIP) et de distribution européenne (ADP), les grossistes répartiteurs, et se mobilise pour l’amélioration des conditions de distribution et de libre circulation des produits définis tels que : les médicaments, les dispositifs médicaux et produits parapharmaceutiques et vétérinaires, au sein de l’Union européenne. Membre de France MVO, l’association s’est engagée notamment, au sein du Club inter pharmaceutique (CIP) à la mise en œuvre de la sérialisation en France.
Au sein de l’UE, les prix des médicaments varient en fonction des états membres car les fabricants négocient auprès de chaque état, un prix différent. Lorsqu’un nouveau médicament est créé, le titulaire du brevet peut interdire à d’autres entreprises de fabriquer et de vendre son médicament, mais il ne peut pas interdire aux grossistes sous licence qui ont acheté le produit au titulaire du brevet de le revendre dans d’autres pays de l’espace économique européen où le titulaire du brevet le vend à un prix plus élevé.
Les importateurs parallèles achètent ces produits pharmaceutiques puis, dans des conditions strictement réglementées, acheminent les médicaments vers le marché de destination, les reconditionnent pour les rendre conformes à la législation nationale et aux besoins linguistiques, et les vendent à un prix inférieur au prix local standard, en concurrence avec ce même produit identique vendu par le fabricant ou son licencié local. Les importations parallèles constituent la seule forme de concurrence par les prix, pendant la période de protection du brevet d’un médicament (appelée concurrence intra-marque). Le commerce parallèle de médicaments crée de la concurrence dans un secteur où les brevets confèrent au titulaire des droits un monopole sur chaque marché national.


Le commerce parallèle de médicaments fait partie intégrante de la chaîne d’approvisionnement des médicaments dans le marché unique européen. Il découle des principes de libre circulation des marchandises (article 34 et 35 du traité sur le fonctionnement de l’Union européenne (TFUE)), sous réserve des dérogations concernant la protection de la santé et de la vie des personnes et la protection de la propriété industrielle et commerciale (article 36 du TFUE). Cette activité est protégée par le principe d’épuisement des droits de propriété intellectuelle (PI) qui empêche les titulaires de droits de restreindre la distribution ultérieure de leurs produits une fois qu’ils les ont eux-mêmes placés sur un marché donné de l’Espace économique européen.
Ainsi, le commerce parallèle des médicaments est légal mais aussi strictement réglementé par la directive sur les médicaments à usage humain (directive 2001/83/CE), la directive sur les médicaments falsifiés (directive 2011/62/UE), la directive rapprochant les législations des États membres sur les marques (directive 2015/2436/UE), le règlement pour l’autorisation et la surveillance des médicaments à usage humain et vétérinaire et instituant une Agence européenne des médicaments (règlement (CE) n°726/2004), la communication de la Commission sur les procédures communautaires d’autorisation de mise sur le marché des médicaments (communication 98/C 229/03 de la Commission).
Des exigences différentes s’appliquent aux deux types de distributeurs, exportateurs et importateurs, sur le marché. Les exportateurs doivent posséder: une licence de grossiste-distributeur (appelée licence de bonnes pratiques de distribution (BPD) et une autorisation pour les médicaments contrôlés, s’ils exportent des médicaments contrôlés.
Les importateurs doivent posséder la licence GDP, une autorisation de mise sur le marché (qui leur permet de commercialiser un médicament donné sur un marché donné), une licence de fabrication (appelée licence de bonnes pratiques de fabrication (BPF)) s’ils apportent des modifications à l’étiquette ou à l’emballage extérieur comme l’exige la législation locale, et une autorisation pour les médicaments contrôlés, s’ils importent des médicaments contrôlés. Toutes les autorisations et licences sont accordées et contrôlées par les autorités des États membres ou par l’EMA.
Pour toute importation parallèle sur le territoire: il faut respecter la procédure en vigueur prévue par l’Agence nationale de sécurité des médicaments et des produits de santé (ANSM).
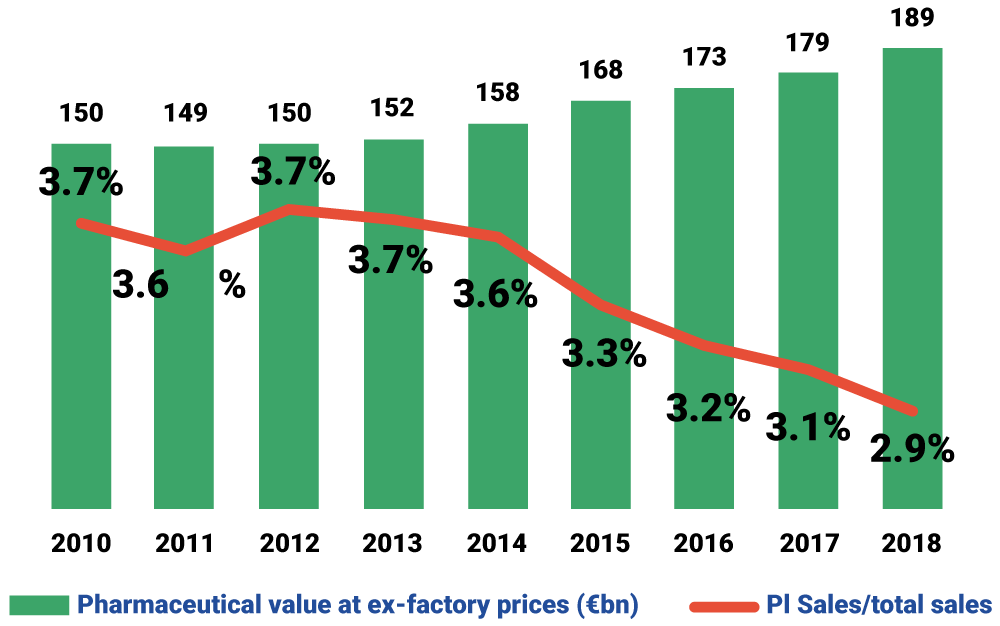
Alors que les ventes de médicaments dans l’UE ont connu une croissance rapide au cours de la dernière décennie, atteignant 189 milliards d’euros en 2018, le chiffre d’affaires des importations parallèles de l’UE est resté stable sur la même période autour de 5,5 milliards d’euros. En 2018, les ventes d’importations parallèles ne représentaient qu’environ 2,9% des ventes totales de produits pharmaceutiques en Europe.
L’origine des importations parallèles est assez répartie entre les pays européens et, contrairement aux idées reçues, la plupart des médicaments importés parallèlement proviennent de pays à hauts revenus.
a sécurité des médicaments est garantie car les distributeurs parallèles sont soumis aux mêmes exigences réglementaires que les fabricants de produits pharmaceutiques de marque ou génériques, et doivent se soumettre à des inspections régulières de la part des autorités compétentes. Les distributeurs parallèles doivent posséder une licence de distributeur en gros de l’UE/EEE .Cela comprend la vérification des produits, la vérification des fournisseurs et l’audit. Pour qu’une entreprise obtienne une licence, elle doit satisfaire aux exigences définies dans les lignes directrices de l’UE sur les bonnes pratiques de distribution (BPD), conformément à l’article 84 de la directive 2001/83/CE.
Cela garantit que la qualité et l’intégrité des médicaments sont préservées dans la chaîne d’approvisionnement. Pour les entreprises qui effectuent également du reconditionnement, le respect des directives relatives aux bonnes pratiques de fabrication (BPF) est également requis. Les membres doivent respecter un code de conduite opérationnel strict , ainsi que des directives de bonnes pratiques en matière de distribution parallèle. L’association européenne réalise également son propre système d’audit, dans le cadre duquel les membres, sur une base volontaire, doivent se conformer à des exigences supplémentaires visant à garantir les meilleures pratiques en matière de distribution parallèle.
Avec l’introduction de la directive sur les médicaments falsifiés (FMD), les produits importés en parallèle doivent porter à la fois des identifiants uniques (codes-barres 2D) et des dispositifs anti-altération comme tous les autres médicaments. Nos produits respectent ce système. L’association a participé en qualité de membre de France MVO à mettre en œuvre ce dispositif. France MVO est l’organisme responsable de la gestion du système de vérification des médicaments en France et en charge de l’interopérabilité informatique du système de vérification de chaque médicament. France MVO opère son interconnexion avec le système informatique européen pour vérifier les codes uniques aléatoires qui seront apposés sur chaque boîte de médicament.

Les produits importés par les distributeurs parallèles doivent avoir une autorisation de mise sur le marché délivrée par des grossistes autorisés de l’UE ou des fabricants d’autres pays de l’EEE. Les destinations possibles des médicaments sont des grossistes agréés, des pharmacies enregistrées ou d’autres personnes autorisées à vendre des produits pharmaceutiques au grand public. Les membres de l’association ont pour mission de préserver la sécurité de la chaîne d’approvisionnement en bloquant l’entrée de médicaments falsifiés, mais ce sont aussi eux qui, souvent, les identifient et alertent les autorités lorsqu’ils circulent sur notre territoire. Grâce à leur grande expérience en matière de reconditionnement et de réétiquetage, les commerçants parallèles sont très souvent en mesure d’éliminer les emballages suspects avant qu’ils ne soient mis sur le marché. La différence entre l’emballage original et l’emballage falsifié est normalement très subtil, mais les importateurs parallèles disposent d’experts qui comparent méticuleusement les emballages avec les informations originales fournies par le titulaire de l’autorisation de mise sur le marché et signalent toute possibilité de contrefaçon.
“Deux éléments conduisent à relativiser l’impact des exportations parallèles de médicaments sur le marché français. En premier lieu, l’activité d’exportation des grossistes-répartiteurs semble désormais limitée dans son ampleur : elle oscille généralement entre 1,5 % et 3 % de leur chiffre d’affaires, la moyenne se situant à 2 %. Toutes les organisations de grossistes-répartiteurs interrogées par votre mission d’information assurent n’exporter que lorsqu’elles sont sûres de pouvoir honorer les demandes de leurs clients en France. En second lieu, les hôpitaux sont régulièrement exposés à des tensions d’approvisionnement, alors que seulement 5 % des commandes des grossistes-répartiteurs sont destinées aux hôpitaux.”
Malgré les efforts déployés pour garantir l’accès aux médicaments, les pénuries se sont multipliées ces dernières années. En partenariat avec les entreprises du médicament (LEEM), et l’association GEnérique Même MEdicament (GEMME), l’association a participé à l’élaboration de la plateforme baptisée TRAC Stocks (Traçabilité, Risque, Anticipation, Consolidation des stocks) pour les médicaments d’intérêt thérapeutique majeur. Le nouvel outil permet à la fois de centraliser dans un format unique toutes les données, de prendre plus rapidement les éventuelles mesures afin de sécuriser les approvisionnements, d’avoir une vision globale par médicament et de diffuser les informations sur la couverture disponible auprès des professionnels de santé. Déployé en priorité fin 2020 pour les médicaments nécessaires à la réanimation dans le cadre de l’épidémie, le dispositif a été étendu progressivement depuis le premier trimestre 2021. Les patients européens sont protégés par l’obligation de service public inscrite dans l’article 81 de la directive 2001/83, qui stipule que : “Le titulaire d’une autorisation de mise sur le marché d’un médicament et les distributeurs dudit médicament effectivement mis sur le marché dans un État membre veillent, dans les limites de leurs responsabilités, à assurer une délivrance appropriée et continue de ce médicament aux pharmacies et aux personnes autorisées à délivrer des médicaments, de façon à couvrir les besoins des patients dans l’État membre en question.” Affordable Medicines France s’engage pleinement à faire en sorte que les exportations parallèles ne soient jamais à l’origine d’une pénurie et travaille de manière proactive avec les autorités françaises pour que ce soit le cas.


L’objectif du commerce parallèle est d’offrir aux français un approvisionnement en médicaments à un prix inférieur. Cela permet de réaliser des économies considérables pour l’assurance maladie, les pharmacies et, donc les patients. Ces économies proviennent des différences de prix pratiqués par les fabricants pour un même médicament entre les pays de l’espace économique européen. Il existe deux grandes catégories d’économies provenant du commerce parallèle : les économies directes et indirectes.
Les économies directes sont les avantages les plus immédiats du commerce parallèle. Elles sont dérivées de la différence entre le prix du fabricant pour un certain médicament et l’alternative moins chère importée en parallèle. Les économies directes représentent les avantages de l’offre d’un produit pharmaceutique répondant aux mêmes normes de sécurité et de qualité à un prix inférieur.
Plusieurs études sur les économies réalisées grâce au commerce parallèle ont mis en évidence les effets positifs des importations parallèles sur la réduction des budgets nationaux de santé. Les plus récentes obtiennent des économies de 202 M€, 60 M€, 31 M€ et 67 M€ par an pour l’Allemagne, la Suède, le Danemark et la Pologne respectivement. Ces chiffres sont relatifs à la taille de leurs marchés pharmaceutiques et dépendent également d’autres éléments : les incitations à fournir des médicaments importés en parallèle, les obstacles à l’entrée des importations, les différences de remboursement, le degré de concurrence des importateurs parallèles sur le marché.
Les économies indirectes sont celles qui découlent de la pression concurrentielle exercée par les commerçants parallèles, qui a un effet sur les prix des fabricants. La concurrence des produits importés parallèlement sur le marché entraîne des réductions des prix des médicaments commercialisés par les fabricants.
Une série d’études récentes qui ont calculé les économies réalisées grâce aux importations parallèles en Pologne, en Allemagne, en Suède et au Danemark, publiée par Affordable Medicines Europe, a révélé que les économies indirectes s’élevaient à un total de 2,8 milliards d’euros dans les quatre pays. Si les dernières restrictions au commerce parallèle étaient supprimées, l’effet de la concurrence de l’import parallèle sur la réalisation d’économies augmenterait considérablement.